
News information
分类:行业资讯 发布时间:2023-04-11 访问量:879
近年来,蛋白水解靶向嵌合体(Proteolysis-targeting chimeras, PROTACs)飞速发展,正在逐渐取代传统小分子抑制剂的地位。然而,水溶性差和细胞渗透性低等问题造成了较差的药代动力学(PK)的性质,从而限制了PROTAC在临床中的应用。这就需要使用适当的递送系统来改善这些缺陷。
PROTAC原理及研究现状
PROTAC概念最早由耶鲁大学Crews课题组于2001年提出,PROTAC 是由两个配体组成的异双功能分子,由一个灵活的化学连接链连接而成,从而使它们能够同时结合E3泛素连接酶和目标蛋白(POI)。PROTAC分子可以通过募集E3泛素连接酶,诱导靶点的多聚泛素化,随后泛素-蛋白酶体系统 (UPS) 降解POI(图1)。
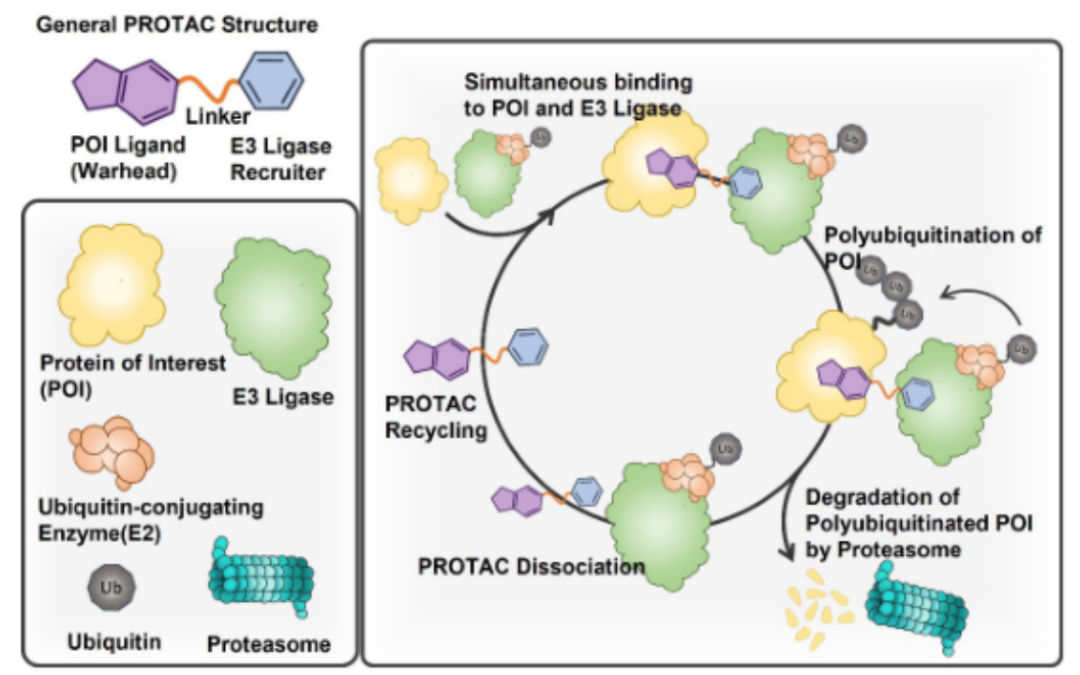 图1.PROTAC的作用机制
图1.PROTAC的作用机制
随着PROTAC技术的不断成熟,目前的PROTAC技术备受许多公司和资本青睐。首先,PROTAC技术的先驱和领军人物纷纷创立公司,开发靶向蛋白降解技术。国外公司有Arvinas、C4 Therapeutics、Kymera Therapeutics、Vividion、Nurix、Oncopia Therapeutics等,国内也有海思科、苏州开拓、海创药业都在布局。目前,约有20多个PROTAC进行临床试验(图2)。其中,进展最快是Arvinas研发的靶向雌激素受体ER的ARV-471,目前处于临床三期。
值得注意的是,这些开展临床试验的PROTAC都是通过招募两种类型的E3连接酶,cereblon (CRBN)和von Hippel-Lindau (VHL) E3连接酶。尽管,目前已经发现了600多种E3连接酶。相比之下,CRBN和VHL是广泛用于PROTAC的最具代表性的E3连接酶。因为,与其他E3连接酶相比,它们在癌细胞中异常丰富,并且很容易招募,同时也报道了许多它们的配体。虽然也研究了其他E3连接酶,如细胞凋亡抑制蛋白(cIAP)和MDM2,但大多数PROTAC仍然以招募CRBN或VHL为主。
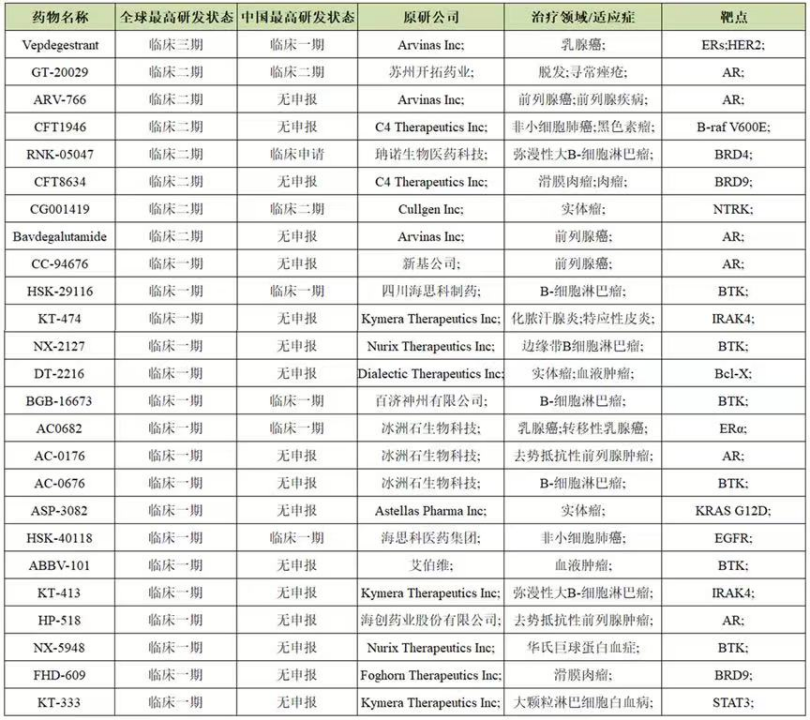
图2.处于临床阶段的PROTAC汇总
PROTAC临床转化面临的难题
当前,传统的治疗策略大部分是基于“占据驱动”作用模式抑制致病靶蛋白的功能,从而发挥疾病治疗作用。不同于传统的小分子抑制剂和拮抗剂,蛋白降解剂技术由于其能够诱导致病靶蛋白的降解,可解决传统小分子或生物大分子无法解决的难题。与抑制剂和抗体相比,PROTACs的治疗效果更持久,因为它们催化和不可逆地清除致癌蛋白。
尽管PROTAC在癌症治疗方面具有突出的特点,但由于结构特性固有的缺陷,它们向临床试验的转化停滞不前。
①PROTAC结构中包含至少两种蛋白质配体,因此不可避免地具有超过700 Da的高分子量。此外,它们还具有许多极性化学键,可以增加拓扑极性表面积(TPSA)。因此,PROTAC分子的高分子量和大TPSA降低了其细胞通透性,提高了膜转运体的外排速率。
②此外,PROTACs水溶性差,导致其在生物介质中的不稳定性。PROTACs的低血清稳定性和细胞渗透性影响了它们的PK和生物利用度,最终导致在正常组织中的不良分布和治疗失败。
基于此,有的研究者会考虑通过化学优化PROTAC的结构,来部分减轻它们的劣质性能。但是,TPSA与水溶性成正比关系,因此降低分子极性以增加细胞通透性会对PROTACs的水溶性和PK性质产生不利影响。此外,PROTAC分子的结构优化也很耗时耗力,而且由于所有PROTAC分子的理化参数值不同,适用性较低。此外,大多数修饰方法只是为了调节它们的细胞渗透性,而不是它们的生物分布。因此,需要使用适当的递送系统来改善PROTAC这些问题。
癌症特异性PROTAC递送系统的研发策略
目前,各种类型的递送系统,包括有机/无机纳米颗粒,小分子靶向部分和抗体已被探索作为PROTAC载体(图3)。它们可以调节PROTACs较差的水溶性和细胞渗透性,调节其PK性质,并通过被动或主动靶向方法促进PROTACs在肿瘤组织中的选择性定位。
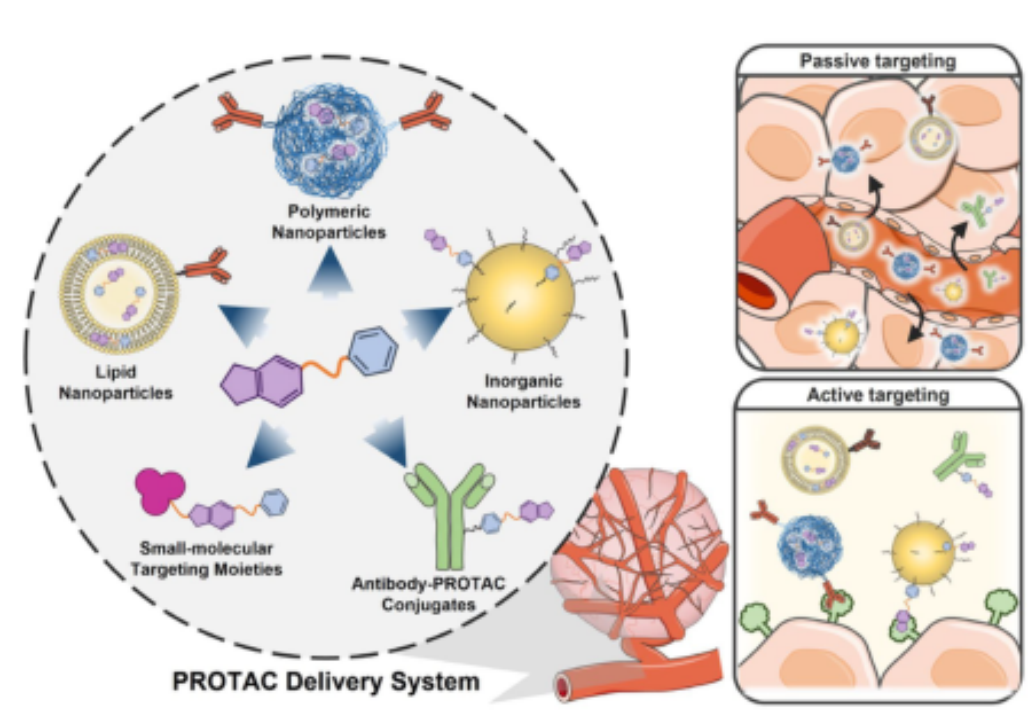
图3. PROTAC的递送系统
几十年来,人们设计和探索了多种具有高生物相容性、生理稳定性和多种功能的高分子纳米颗粒用于药物递送。其中聚乙二醇嵌段共聚物(PEG)与聚(D,L-lactideco-glycolide) (PLGA)是最具代表性的聚合物给药体系之一,已获得FDA批准。
纳米颗粒长期以来被用于调节水溶性差的药物PK性质。通常,纳米颗粒的尺寸比药物分子大得多,因此一旦药物装入纳米颗粒,药物的溶解度就完全取决于纳米颗粒的溶解度。此外,纳米颗粒还可以为药物提供更长的血液循环,因为它们在生理条件下比小药物分子具有更高的稳定性。Genexol®-PM(用聚合胶束配制的紫杉醇)和Doxil®(脂质体阿霉素)是纳米颗粒调节药物理化性质的代表性例子。
肿瘤组织内异常多孔的血管结构和淋巴引流不足,增强了纳米颗粒在一定尺寸范围内的肿瘤积累,这就是俗称的增强渗透性和潴留(EPR)或被动靶向效应。纳米颗粒一旦在肿瘤组织中定位,就可以被癌细胞通过几种摄取途径内吞,如微胞吞、网格蛋白依赖的内吞、小穴蛋白依赖的内吞和网格蛋白/小穴蛋白不依赖的内吞等,随后在细胞内释放活性药物。受到纳米颗粒的药物递送系统成功的启发,研究人员也开始研究纳米颗粒被应用于改善PROTAC的不良理化性质。
3.1.1 脂质纳米颗粒
2021年,Tufts 大学的xiao bing xu研究团队利用脂质纳米颗粒在细胞内递送与E3连接酶预融合的BRD4 PROTACs(ARV-771)。ARV-771由BRD4配体和VHL连接酶配体组成。首先,作者在体外优先与VHL蛋白融合制备预融合PROTACs,随后将它们包裹在80-O14B脂质纳米颗粒中。当该复合物进入细胞后,预融合PROTACs直接与靶蛋白结合,降解BRD4蛋白。作者认为,预融合的PROTAC有望通过将三元络合物要求的UPS系统转化为简单的二元络合物系统来提高BRD4的降解效率。此外,脂质纳米颗粒有助于预融合的PROTAC内化到癌细胞,从溶酶体中逃逸,并在细胞质内顺利发挥功能(图4)。

图4. 纳米脂质体包裹的预融合的BRD4 PROTACs的作用机制
3.1.2 无机纳米颗粒
无机纳米颗粒,如二氧化硅、金、氧化铁和量子点,是PROTAC递送的其他候选者,可以表现出与有机纳米颗粒不同的特性。与有机纳米颗粒相比,无机纳米颗粒的形态和尺寸分布可以更精确地控制,并且其刚性结构降低了在脱靶位点发生不利药物泄漏的风险。金纳米颗粒(GNP)由于其生物惰性、完善的表面修饰方法和赋予额外功能的多功能性而被广泛研究作为药物载体。
中国药科大学wenyuan liu课题组设计了基于GNP的多头PROTAC递送体系(Cer/Pom-PEG@GNP)用于治疗非小细胞肺癌(NSCLC)(图5)。作者将间变淋巴瘤激酶(ALK)结合弹头(Cer-PEG-SH)和CRBN E3连接酶受体(Pom-PEG-SH)通过硫醇-金相互作用偶联到直径为~32 nm的GNPs上,制成了ALK降解的PROTACs复合体(图5)。作者认为,Cer/Pom-PEG@GNPs的多靶头特征促进ALKs和E3连接酶的相互作用,因此表现出比小分子双功能PROTACs更好的治疗效果。此外, GNPs的应用不仅可以调节PROTAC的PK差,还可以通过EPR效应调节PROTAC的肿瘤特异性富集。然而,除了金之外,其他无机纳米颗粒尚未用于PROTAC的递送。
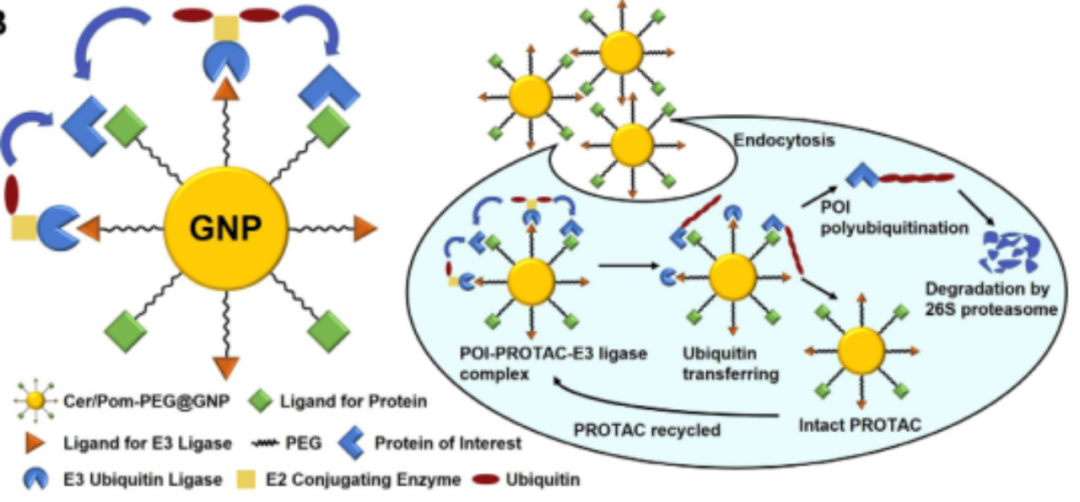
图5.Cer/Pom-PEG@GNPs的设计思路
主动靶向策略主要利用靶向配体与癌症过表达膜受体的特异性结合亲和力。通过使用活性靶向部分进行PROTAC传递,可以调节PROTAC不良的细胞渗透性,因为它们是通过促进受体介导的内吞作用,而不是通过简单的跨膜扩散途径内化。内吞的PROTAC分布在细胞质中,进而催化POIs的降解。并且,主动靶向部分促进共轭PROTACs的癌症选择性富集,降低其脱靶传递引起的全身毒性。目前,已经报道了几种活性靶向部分用于PROTAC的递送,它们可以根据分子结构依次分为小分子、抗体和适配体。
3.2.1 小分子靶向-PROTAC缀合物
首先是基于小分子靶向单元的PROTAC递送体系。2021年,西奈山医学院金坚课题组采用小分子叶酸基团作为靶向配体进行癌选择性PROTAC递送(图6)。叶酸基团通过形成酯基与PROTAC分子结合,这些酯基可被细胞内水解酶裂解。与其他正常组织相比,叶酸受体在各种癌症(如卵巢癌、乳腺癌、肾癌和结直肠癌)中高度表达,因此“叶酸笼子”PROTACs以受体依赖的方式被癌细胞特异性吸收,并成功介导POI降解。
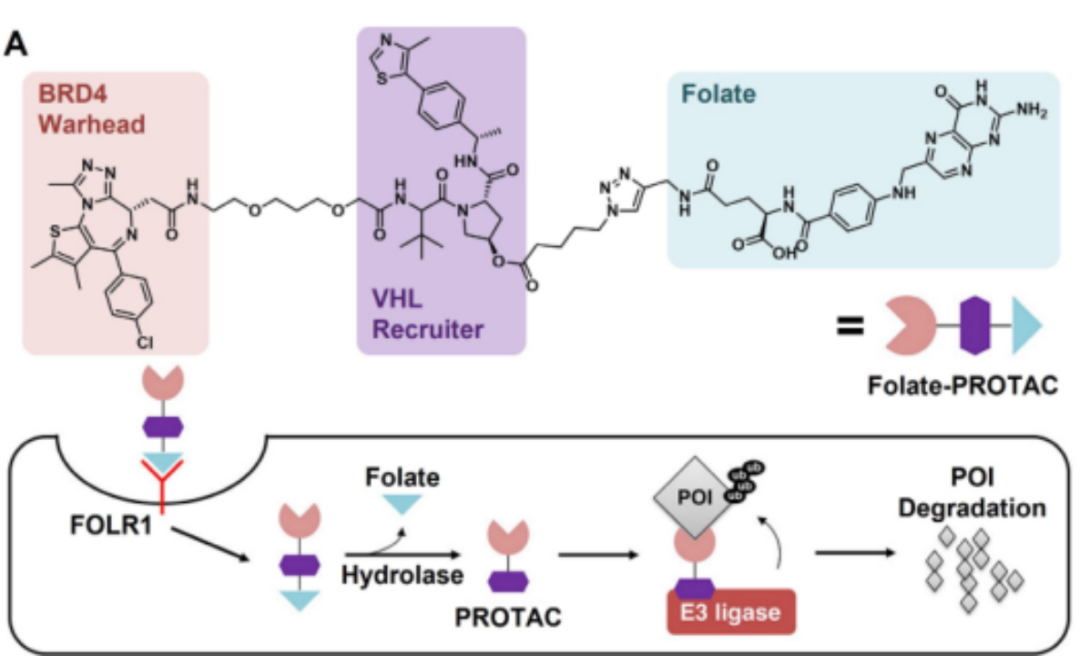 图6.基于叶酸小分子-PROTAC的递送策略
图6.基于叶酸小分子-PROTAC的递送策略
虽然小分子配体可以赋予PROTAC分子一种癌症特异性的结合能力,但由于这些配体的分子尺寸太小,不足以有效地调节PROTAC分子水溶性差等问题。由于其相对庞大的结构,抗体不仅弥补了偶联PROTACs较差的溶解度,而且决定了PK性质。除了具有积极的肿瘤靶向性外,抗体通常比小分子配体具有更长的血液半衰期,因此更适合药物输送。其中,最成功的案例莫过于ADC药物。
3.2.2 抗体靶向-PROTAC缀合物
2020年,Edward W. Tate团队BRD4首次提出了ab-PROTAC概念。作者将BRD4 PROTACs与抗HER2单抗(曲妥珠单抗)结合,成功构建了靶向HER2阳性乳腺癌的Ab-PROTAC,并成功降解了乳腺癌细胞中的BRD4蛋白(图7)。由于曲妥珠单抗的特异性靶向性,Ab-PROTAC结合物表现出强烈的肿瘤摄取,而很少内化到HER2阴性的正常细胞。PROTACs内吞癌细胞后,与曲妥珠单抗之间的酯键被水解,释放出游离的PROTACs,诱导不可逆的BRD4降解。
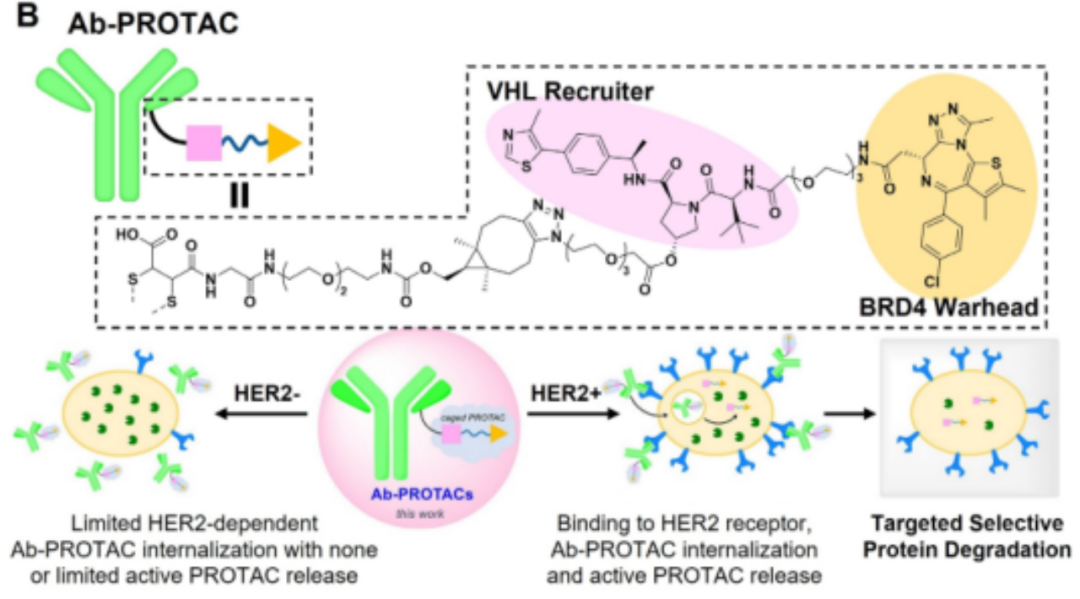
图7.基于抗体-PROTAC的递送策略
3.2.3 核酸适配体-PROTAC缀合物
核酸适配体是核糖核酸(RNA)或脱氧核糖核酸(DNA)为基础的具有短和单链初级结构的靶向部分。由于其高结合亲和力、稳定的重复性和低免疫原性,适配体在分子成像和药物传递方面已被广泛研究。2021年,海军军医大学的盛春泉课题组报道了BRD4 PROTACs和核仁靶向适配体组成的适配体- PROTAC缀合物,可用于乳腺癌的治疗。PROTAC通过含有二硫基的短链与适配体连接,在谷胱甘肽(GSH)存在下可以被裂解。该适配体- PROTAC结合物仅对过表达核仁的癌细胞具有显著的BRD4降解活性,有利于调节PROTACs较差的溶解度和PK性质。此外,适配体- PROTAC缀合物比抗体- PROTAC缀合物更有优势,因为它们具有更高的生理稳定性,可以规避抗体的免疫原性。
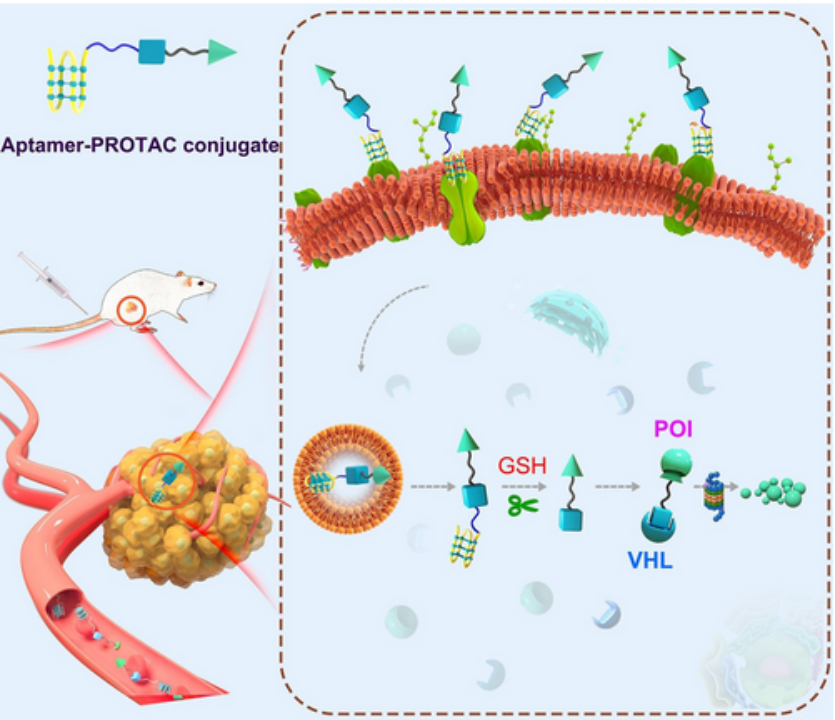
图8. 基于核酸适配体-PROTAC的递送策略
3.2.4 主动靶向半功能化纳米颗粒-PROTAC缀合物
PROTAC与抗体或适配体的直接偶联已被证明可以增加PROTACs的肿瘤选择性积累,并成功地调节其不良的PK性质。然而,Ab-PROTAC在装载能力方面存在局限性。研究表明,主动靶向半功能化纳米颗粒可以用作PROTAC载体,并可以显著改善PROTAC的装载问题。与抗体相比,纳米颗粒在PK中受负载量的影响较小,因此能够容纳相对大量的PROTAC。此外,具有主动靶向部分的纳米颗粒表面修饰可以通过利用被动和主动靶向方法促进PROTACs增强肿瘤富集。
2022年,上海药物所于海军团队提出了一种基于PROTAC的癌症联合治疗的多功能聚合物递送系统(图9)。作者设计了一种自组装的聚合物纳米颗粒,通过生物正交化学靶向到肿瘤组织,其表面的PEG被TMEs中的基质金属蛋白酶2 (MMP2)裂解。作者将BRD4降解剂(ARV-771或MZ1光敏剂)与谷胱甘肽(GSH)敏感键化学偶联到聚合物纳米颗粒上。而聚合物纳米颗粒可以通过适应生物正交化学和多种刺激敏感策略,使PROTAC和光敏剂高度选择性地传递到肿瘤组织。此外,作者发现当它们被用于乳腺癌模型时,BRD4降解作用和光动力治疗(PDT)协同促进了癌细胞的凋亡,从而实现了有效的肿瘤消退。
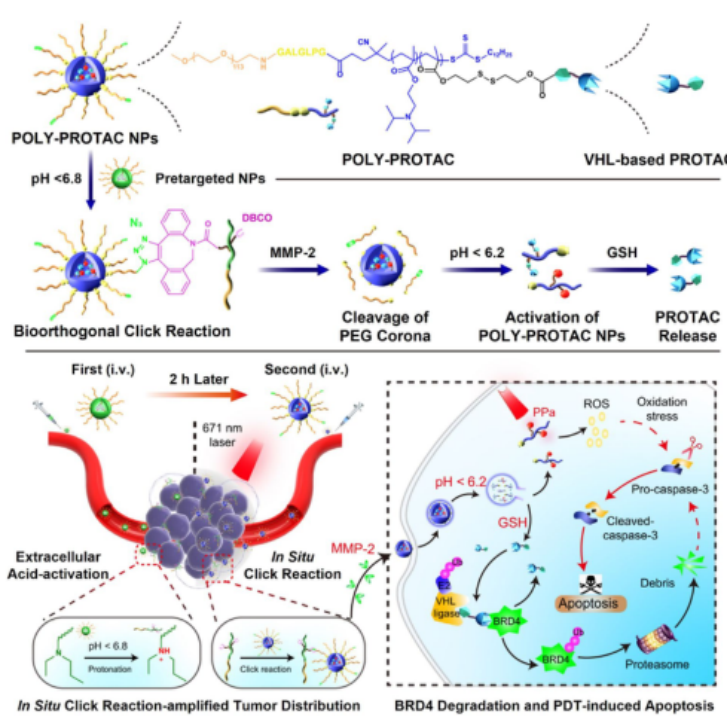
图9. 基于主动靶向半功能化纳米颗粒的PROTAC递送策略
小结
PROTAC被认为是一种新型的治疗策略,潜力无限。然而,PROTAC的水溶性差和细胞渗透性低等问题造成了较差的药代动力学(PK)的性质,从而限制了PROTAC在临床中的应用。针对PROTAC递送系统的开发能加快其从实验到临床的转化步伐。这些递送系统能够优化PROTAC的理化性质、实现靶向递送、促进细胞内积累和提高其降解效力。
然而,挑战与机遇并存,PROTAC的递送仍然存在一些挑战。首先,额外的载体材料和药用辅料可能会增加与PROTAC相关的制造成本。其次,PROTAC和相应的药物递送系统的安全性必须得到严格保障,在发挥其优化效果的同时确保其副作用在可接受范围内。
尽管,目前基于PROTAC的递送策略尚处于起步阶段,但未来可期,期待更多安全有效的PROTAC体系被开发,以改善PROTAC理化性质等问题,为患者带来福音!
来源于网站,如有侵权请联系删除。

国家医保部门从多个方面考虑到参保人员的利益,进而对相关政策进行调整和完善,提升居民的生活幸福感。
2020年-2025年,因新品上市以及患癌人数不断增加,因此从市场规模也随之上升。根据头豹研究院整理,ADC药物的市场规模预计在2024年有望达到74 亿元,2030年预计市场规模达到292亿元人民币,2024-2030年复合增长率为25.71%。

国家卫生健康委发布最新公告显示,2020年各类传播途径的甲乙类传染病发病率均呈现明显下降,其中肠道传染病发病率较2019年下降29.4%、呼吸道传染病发病率较2019年下降12.9%。因此,全球,包括中国在内的抗菌药物的使用额呈下降趋势。

随着新药的不断研发和政策的完善,渐冻症治疗市场有望迎来更加广阔的发展前景。