
News information
分类:行业资讯 发布时间:2023-05-19 访问量:825
FDA首次对HER2-ADC采取了CRL行动,近日(5月15日),Byondis宣布收到了FDA发布的一封拒绝批准HER2-ADC的完整回复函(CRL),作为HER2阳性乳腺癌的三线治疗。Byondis公司在未披露CRL中的具体原因,只是在公司的一封新闻稿中提到FDA需要额外的数据来支持其审批决定。这也是FDA首次对提交上市的HER2-ADC采取了拒绝措施。
虽然在美被拒,但是Byondis表示仍将继续推进SYD985在欧盟和英国的上市,此前已经在这两个国家/地区提交了上市申请,基于TULIP的III期临床数据。
值得注意的是,SYD985是一个真正在结构和技术上很创新的产品,但最终落实到临床疗效上面却与HER2 ADC领域如今的“王者”DS-8201相形见绌,此类问题实际也是不少创新药面临的一大“通病”。从上市之日起,DS-8201就以“龙卷风摧毁停车场”之势,拿下了乳腺癌、胃癌领域的多个适应症。2023年一季度,DS-8201销售额已达到5.1亿美元,超越第二代HER2 ADC 药物T-DM1指日可待。
近两年来,合作金额动辄数十亿美元的ADC License-out交易让国内产业界对ADC出海信心倍增,产生了中国ADC能够与海外创新药一决高下的期望。这一泼冷水倏然降临,虽降不了HER2 ADC场子的热,却能给予在场者一定提醒。
这一结果让人不禁联想到一年前,中国PD-1的出海遇阻,原因是需要以更多临床数据用以支持审批。彼时,这一事件被认为是PD-1内卷式竞争的“滑铁卢”,而在Byondis被拒绝之际,其理由有着熟悉的味道,那HER2 ADC是否会步入PD-1后尘,终也要复刻PD-1的“悲剧”?
01
强者在前
为什么被拒绝?Byondis并没有过多披露FDA在CRL中回复的信息,主要表示公司还需要提供更多的信息来支持审批决定,且这些信息还需要额外的时间来审查。Byondis为此感到遗憾,表明了会继续推进SYD985在欧盟和英国的上市,但关于下一步是否要带着更多信息在FDA申请上市,暂未作出说明。
虽然在全球HER2 ADC已然成为研发热潮的当下,已上市产品仅有4款(包括在中国获批上市的维迪西妥单抗),而已经得到临床III期研究验证的HER2 ADC产品也并不算多。但SYD985,经历了十年征途之后,终于走到了III期验证这一步,且展现出了一定的应用前景。早在2018年1月,基于其I期临床试验数据,该产品就获得了FDA的快速通道认证,这在当时,无疑算得上是先行者。
论起技术和创新度,SYD985值得被认可。该产品的研发采用了Byondis的duocarmazine连接子药物(Linker-drug,LD)创新技术平台。
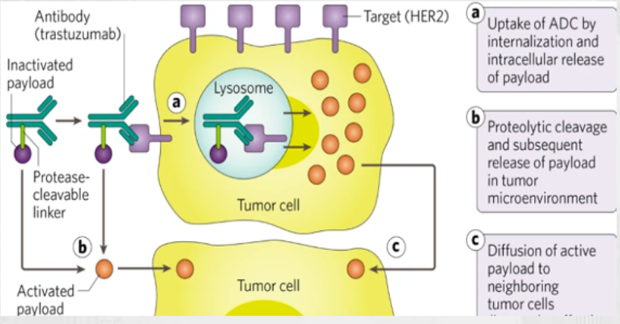
据了解,虽然早期的ADC药物能改善靶向性和细胞杀伤作用,但在血液循环中的稳定性不高,而基于LD技术平台研发出的ADC携带的细胞毒性药物一旦提前释放,会迅速自毁,从而限制对健康的损伤。
2021年9月,SYD985公布了名为TULIP的三期临床试验结果,这一试验比较了SYD985与医生选择的方案(PC)治疗方案,治疗HER2阳性局部晚期或转移性乳腺癌患者的效果。
结果显示,SYD895达到了主要和次要临床终点。具体而言,在无进展生存期这一主要终点上,SYD985组为7.0个月,PC组为4.9个月。在次要终点总生存期上,SYD985组为20.4个月,PC组为16.3个月,可以看到SYD985为患者带来了4个月的生存期改善。在2022年5月,Byondis与medac GmbH达成 合作协议,获得SYD985在欧盟、英国和其他欧洲国家(包括冰岛、列支敦士登、挪威和瑞士)的商业化权益。
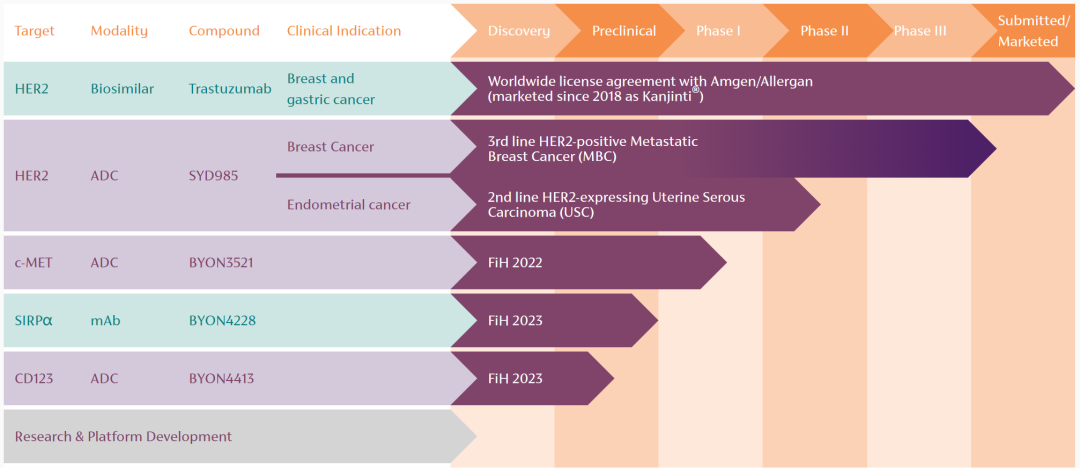
从技术和创新度的思维范畴中跳出来,放到临床的角度来看,SYD985比起同行中Enhertu(DS-8201)和Kadcyla(T-DM1)这两大珠玉,其优势却是愈发弱化。T-DM1是第一个获批HER2阳性晚期乳腺癌适应证的ADC药物,获批时连ADC产品都没几个,不错的数据加之稀缺性,使得T-DM1快速获批上市。
而DS-8201的问世更是刷新了HER2 ADC在乳腺癌领域的“天花板”,2021年ESMO大会公布的临床研究DESTINY-Breast01(DB01)最终数据显示,针对既往平均接受过6线治疗的患者,DS-8201的客观缓解率(ORR)高达62.0%,中位PFS长达19.4个月,中位OS长达29.1个月。由于惊艳的疗效,FDA在2019年即批准了DS-8201用于HER2阳性晚期乳腺癌的三线及三线以后的治疗。之后与T-DM1做了头对头对比,成功挑战彼时二线治疗标准T-DM1,成为新的二线治疗标准。也就是说,今时不同往日,眼下的情况是DS-8201几乎改变了HER2阳性乳腺癌二线乃至整体的治疗格局,市场已经见识到了DS-8201的惊艳,SYD985要想挤入强者的领地,还是需要拿出显著差异化的数据。
02
中国ADC出海,是否会重蹈PD-1覆辙
HER2 ADC被FDA拒绝批准,听起来和来自中国的PD-1被FDA拒绝的故事似乎殊途同归,不免让人心生疑虑,中国的HER2 ADC出海是否也会重蹈PD-1覆辙?
时间回到2022年年初,信达生物收到了FDA的完整回复函,其中建议信迪利单抗联合化疗与一线转移性NSCLC的标准疗法进行以总生存期为终点、多区域的非劣效性临床试验。也就是说,FDA希望信达生物给出信迪利单抗对比美国市场一线NSCLC标准疗法疗效更优的临床数据以支持批准,实际上这是一个“反内卷”的行为。
过去的两年时间里,ADC赛道一度是创新药领域中热度最高的地方。越来越大的ADC交易额、越来越多的ADC交易案例,一度让每个身处其中的人对ADC赛道“上头”,不管是传统药企还是Biotech都纷纷加入到了ADC的研发队列中。但很显然,并不算每个ADC都会有未来,那些临床数据不够硬的ADC药物,最终很难在ADC的乱战中活到最后,FDA对于SYD985的拒绝,便是最好的佐证。虽然,大家对于DS-8201的问世,将会将阻碍其他ADC药物的未来这件事已经有预期。但在ADC的热潮下,很多人选择将这种隐忧自动屏蔽。
有业内人士认为,“不论如何,FDA拒绝批准HER2 ADC产品,无疑是给行业浇了一盆冷水。他们需要思索和正视手中的HER2 ADC是否还能走下去,说故事的时代已经过去,要看到严峻的形势,懂得及时止损。前有PD-1企业暂停大三期临床,数十亿元打水漂,如今的HER2 ADC要谨慎对待。”并且可以预想,FDA对于ADC的严格把控一定不会只出现在HER2 靶点上,随着各靶点的ADC热度都在升高,未来在trop2、Claudine 18.2这些热门靶点上,或许也会上演同样的剧情:吃饱的只有领头羊。
来源于网站,如有侵权请联系删除。

国家医保部门从多个方面考虑到参保人员的利益,进而对相关政策进行调整和完善,提升居民的生活幸福感。
2020年-2025年,因新品上市以及患癌人数不断增加,因此从市场规模也随之上升。根据头豹研究院整理,ADC药物的市场规模预计在2024年有望达到74 亿元,2030年预计市场规模达到292亿元人民币,2024-2030年复合增长率为25.71%。

国家卫生健康委发布最新公告显示,2020年各类传播途径的甲乙类传染病发病率均呈现明显下降,其中肠道传染病发病率较2019年下降29.4%、呼吸道传染病发病率较2019年下降12.9%。因此,全球,包括中国在内的抗菌药物的使用额呈下降趋势。

随着新药的不断研发和政策的完善,渐冻症治疗市场有望迎来更加广阔的发展前景。